Это открытие во многом удивительно. Во-первых, оно было сделано тогда, когда теория строения органических соединений только зарождалась и даже сомнения в реальном существовании самих атомов и молекул не были окончательно развеяны. Во-вторых, это редкий случай, когда два исследователя, пусть и хорошо знавшие друг друга, одновременно и независимо пришли к одному и тому же результату. Наконец, нельзя не упомянуть о возрасте первооткрывателей: Ле Белю было 27, а Вант-Гоффу только-только исполнилось 22 года, когда о них заговорило мировое химическое сообщество.
Расплывчатые представления о частицах материи, располагающихся определённым образом в пространстве, встречаются ещё в трудах древних философов. Но только в XIX веке после накопления знаний о строении вещества они начинают приобретать отчётливую форму. Во второй половине XIX столетия Фридрих Август Кекуле в Германии и Арчибальд Скотт Купер в Шотландии высказали основополагающую идею, согласно которой атом углерода во всех органических молекулах четырёхвалентен (то есть образует ровно 4 химические связи). Причём его атомы могут соединяться с другими атомами углерода посредством одинарных, двойных или тройных связей. Чуть позже профессор Казанского университета Александр Михайлович Бутлеров предложил «изображать атом углерода в виде тетраэдра, каждая из четырёх граней которого способна образовывать связь с атомом водорода». Новая теория строения органических соединений (в некоторых школьных учебниках её называют «теорией Бутлерова», что не совсем справедливо) позволяла составлять их структурные формулы. Она показала также, что свойства вещества определяются не только его составом, но и порядком соединения атомов в молекуле.
Конечно, язык органической химии в то время был очень далёк от современного. Например, первооткрыватель структуры бензола Кекуле сначала обозначал атомы углерода в виде вытянутых полосок, похожих на сосиски, но позже перешёл к моделям, близким к используемым сегодня. Глядя на изображения, принятые в XIX веке, не всегда легко догадаться, что за ними «прячутся» формулы, например, самого обыкновенного бензола или этанола!
Новая структурная теория с необычайной лёгкостью объяснила строение сложных молекул и оказалась необходимой для понимания изомерии органических соединений. Однако вскоре выяснилось, что даже на её основе не удаётся интерпретировать ряд экспериментальных фактов. В 1815 году француз Жан-Батист Био и немец Томас Иоганн Зеебек обнаружили, что некоторые органические вещества (например, сахар, камфора, скипидар) и их растворы при прохождении через них поляризованного света способны вращать плоскость поляризации. Причина такой оптической активности оставалась тайной, раскрыть которую пытались многие, в том числе знаменитый французский химик и микробиолог Луи Пастер.
Изучая тартраты — соли винной кислоты, он обратил внимание на две их кристаллические формы, представляющие собой зеркальное отображение друг друга. Вооружившись пинцетом и микроскопом, Пастер вручную разделил кристаллы обоих типов и обнаружил, что водные растворы каждой фракции вращают плоскость поляризации света на один и тот же угол, но в противоположных направлениях. Легенда утверждает, что двадцатишестилетний учёный выскочил из лаборатории, радостно восклицая: «Я только что сделал великое открытие!» Позже он пояснял: «Получаемая химиками винная кислота, неактивная в отношении вращения плоскости поляризации, состоит из двух кислот, вращения которых взаимно нейтрализуют друг друга, поскольку одна вращает вправо, а другая влево в той же самой степени». Такие две формы соединений получили название антиподов, или энантиомеров (от греч. νάντιος — противоположный и μέρος — часть), а их эквимолярная смесь — рацемической (от лат. acidum racemicum — виноградная кислота: именно так издавна называлась известная смесь равных количеств двух энантиомеров винной кислоты, не проявляющая оптической активности). Однако Пастер не высказал никакой гипотезы о строении молекул изучаемых солей, ограничившись лишь макроскопическим описанием асимметрических форм кристаллов.
Несколько лет спустя после экспериментов Пастера немецкий химик-органик Иоганн Вислиценус установил существование трёх изомерных молочных кислот, две из которых, выделенные из природных объектов, были оптически активными, а третья, синтезированная в его лаборатории, такой активности не проявляла. В отличие от Пастера Вислиценус предпринял попытку (небезуспешную!) объяснить полученные результаты. В опубликованной в 1873 году статье он писал: «Поскольку структурные формулы показывают лишь то, как атомы связаны друг с другом, мы должны признать, что, если два вещества имеют одну и ту же структурную формулу, различия в их свойствах следует искать в различном расположении атомов в пространстве»1.
А ведь Вислиценус мог опередить и Вант-Гоффа, и Ле Беля в создании новой области химии — стереохимии. И лишь его чрезмерная осторожность в принятии новых способов изображения молекул не позволила примерить лавры первооткрывателя. Впрочем, такое поведение учёного было понятно: в теории строения органических соединений в то время было ещё много путаницы и хаоса. Простота и глубина подхода, предлагаемого Вант-Гоффом, вместе с геометрической элегантностью предложений Ле Беля положили конец этому периоду.
Статья Вант-Гоффа, вышедшая на нидерландском языке в начале сентября 1874 года, имела многословное название «Предложение о расширении в пространстве структурных формул, используемых в настоящее время в химии, и примечание о соотношениях между оптической активностью и химическим строением органических соединений». Именно в ней молодой учёный впервые высказал гениальную гипотезу, заключающуюся в том, что «сродства (валентности. — Прим. авторов) атома углерода изображаются направленными к вершинам тетраэдра, в центре которого находится сам этот атом. … В случае, когда четыре сродства атома углерода насыщены четырьмя различными одновалентными группами, можно получить два, и только два различных тетраэдра, которые представляют собой зеркальное отражение один другого и мысленно никак не могут быть совмещены, то есть мы имеем дело с двумя изомерными пространственными структурными формулами»2.
Вант-Гофф назвал такой атом «асимметрическим». Затем он показал, что любое оптически активное органическое соединение содержит асимметричный атом углерода, тогда как обратное не всегда верно.
Два месяца спустя в Бюллетене Парижского химического общества появилась статья Ле Беля «Об отношениях, которые существуют между атомными формулами органических тел и вращательной способностью их растворов»3. В ней он попытался сформулировать правило, «позволяющее предвидеть, будет ли раствор вещества обладать вращательной способностью». Согласно этому правилу, «если тело произошло из нашего первоначального типа MA4 замещением A на три различных атома или радикала, его молекула будет асимметрична и будет обладать вращательной способностью».
Причины оптической активности Вант-Гофф и Ле Бель рассматривали по-разному. Первый основывался на гипотезе Кекуле о четырёхвалентности углерода и в то время ещё гипотетической модели углеродного тетраэдра (немецкий химик использовал тетраэдрические модели в своих лекциях, что, возможно, и подтолкнуло Вант-Гоффа к идее асимметрического атома). Такой подход позволял не только объяснить факт существования стереоизомеров, но и предсказать их количество. Второй, будучи очарованным красотой многогранников, изучаемых Пастером, опирался на чисто геометрические представления, вслед за своим соотечественником полагая, что причина оптической активности — молекулярная асимметрия. Возможно, именно поэтому концепция Вант-Гоффа была ближе химикам, нежели абстрактные рассуждения Ле Беля.
Интересно, что оба учёных хорошо знали друг друга: они встретились и познакомились в лаборатории Шарля Адольфа Вюрца в Париже. Вант-Гофф вспоминал об этом периоде: «То, что мы вместе работали в лаборатории Вюрца, было чистой случайностью. Мы никогда не говорили о тетраэдрическом углероде, хотя, возможно, каждый из нас уже вынашивал эту идею, держа её в секрете».
Чтобы донести свои идеи до научного мира, Вант-Гофф опубликовал француз-ский перевод оригинальной работы в Бюллетене Парижского химического общества и в виде отдельной брошюры с лаконичным названием «О структурных формулах в пространстве». Копии последней вместе с самодельными картонными тетраэдрическими моделями он разослал ведущим европейским химикам — Байеру, Бертло, Бутлерову, Вислиценусу, Вюрцу, Кекуле, Франкленду, Хофману. Реакция на эту работу Вант-Гоффа оказалась неожиданно вялой: никто из маститых химиков не снизошёл до дискуссии с начинающим исследователем. «Вант-Гофф и его учение были встречены выдающимися современниками с равнодушием и, даже более, с самыми едкими насмешками», — вспоминал Вальден в статье, посвящённой двадцатипятилетию начала стереохимических исследований. Лишь Вислиценус обратился к Вант-Гоффу с просьбой разрешить опубликовать немецкий перевод его статьи: «Могу ли я сообщить Вам, что Ваши теоретические исследования доставили мне немало удовольствия и великое наслаждение, и в этом я вижу не только необычайно гениальную попытку объяснить факты, до сих пор считавшиеся необъяснимыми, но я также считаю, что это даст хорошее развитие нашей науке и будет иметь эпохальное значение»4.
Однако новые взгляды пришлось отстаивать в жёсткой борьбе. Особенно ярым противником теории о пространственном строении молекул выступал немецкий химик Герман Кольбе. Рассматривая вышедшую статью Вант-Гоффа как «фантастическое сочинение», он не стеснялся в грубых выражениях и оскорблениях: «Некоему доктору Вант-Гоффу, занимающему должность в Утрехтском ветеринарном училище (там Вант-Гофф работал в течение года после защиты диссертации в 1874 году. — Прим. авторов), очевидно, не по вкусу точные химические исследования. Он счёл более приятным сесть на Пегаса, вероятно взятого напрокат из ветеринарного училища, и поведал миру то, что узрел с химического Пегаса в своём смелом полёте, — о расположении атомов в пространстве». «Настоящих исследователей, — продолжал Кольбе, — поражает, как почти неизвестные химики берутся так уверенно судить о величайшей проблеме химии — вопросе о пространственном положении атомов, который, пожалуй, никогда не будет решён»5.
Молодой учёный достойно ответил на эти грубые нападки маститого химика: «Тому, кто считает, что химик не должен трудиться над разработкой теории, потому что он неизвестен и служит в ветеринарном училище, тому, кто не находит достойным приветствовать представителя нового воззрения (может быть, ошибочного) так же, как герои Гомера приветствовали своих врагов перед боем, тому, хотя бы это и был такой заслуженный муж, как Кольбе, я отвечаю, что такое поведение, к счастью, не может быть знамением времени (нем. «Zeichen der Zeit» — именно так Кольбе озаглавил свою статью. — Прим. авторов), а лишь служит для познания отдельного лица».
Своеобразным ответом на критику стала и публичная лекция «Воображение в науке» (Verbeeldingskracht in de Wetenschap), прочитанная Вант-Гоффом 10 ноября 1878 года при вступлении в должность профессора Амстердамского университета. Четверть века спустя, в другой лекции, состоявшейся 16 мая 1904 года, в Утрехте, Вант-Гофф, обращаясь к студентам, сказал: «Я готов поделиться с вами рецептом того, как делаются открытия. Изучая в библиотеке Утрехтского университета работы Вислиценуса о молочных кислотах, я прервал работу на полпути и решил прогуляться. Именно во время этой прогулки на свежем воздухе ко мне и пришла идея асимметрического атома углерода»6.
Обладая одинаковыми физическими и близкими химическими свойствами, энантиомеры могут существенно различаться по запаху, вкусу, а также способности взаимодействовать с биологическими объектами. Например, в молекуле аспартама — широко используемого искусственного подсластителя — есть два асимметрических атома углерода (отмечены звёздочками), у этой молекулы есть четыре стереоизомера. Но лишь один из них имеет сладкий вкус, тогда как его энантиомер — горький.
Все знают о вредных свойствах никотина, «капля которого способна убить лошадь». В молекуле этого алкалоида, содержащегося в листьях и стеблях Nicotiana tabacum, есть один асимметрический атом углерода. А раз так, то он должен существовать в двух энантиомерных формах.
Оказалось, что встречающийся в природе энантиомер никотина почти в три раза более токсичен, нежели его изомер, полученный искусственно в химической лаборатории. А потому для убийства бедной лошади понадобится уже «три капли» последнего.
Более половины всех выпускаемых сегодня фармацевтических препаратов — оптически активные соединения. Чаще всего лекарства, получаемые из природных источников, производятся в виде чистых энантиомеров, тогда как получаемые синтетически продаются в виде рацематов. И всё потому, что разделение рацемата на индивидуальные энантиомерные компоненты требует специальных методов и, как правило, стоит довольно дорого. Однако выпуск рацемической формы лекарства возможен только тогда, когда уверенно доказано, что ненужный энантиомер не обладает биологической активностью или, по крайней мере, не даёт побочных эффектов.
Один из известных трагических случаев связан с продажами рацемической смеси талидомида — соединения, использовавшегося в качестве седативного препарата в Европе с конца пятидесятых годов прошлого века. Было найдено, что один энантиомер талидомида проявляет заметно бóльшую активность, чем другой. Однако по экономическим соображениям препарат продавался в виде рацемата. Беременные женщины принимали его для снятия симп-томов утреннего недомогания — токсикоза и предродового беспокойства. Очень скоро он стал одним из самых популярных среди этой группы препаратов. Тогда же выяснилось, что талидомид обладает не только седативным, но и тератогенным действием: женщины, принимавшие его на ранних стадиях беременности, рожали младенцев с различными дефектами. По разным оценкам, от 8000 до 12 000 детей родилось с вызванными талидомидом уродствами, главным образом без верхних или нижних конечностей, с дефектами зрения и внутренних органов. Несмотря на то, что только один энантиомер — тератоген, специальными исследованиями учёные установили, что в организме пациента может происходить рацемизация, то есть превращение одного энантиомера в другой. А если так, то тератогенный эффект может проявлять и другой энантиомер. Талидомидовая трагедия стала хрестоматийным примером различного воздействия на организм разных энантиомеров одного и того же соединения.
История с талидомидом получила неожиданное продолжение, но уже в позитивном смысле. Недавно выяснилось, что тератогенное действие препарата вызвано его способностью подавлять ангиогенез (рост кровеносных сосудов), необходимый для активно делящихся клеток. Этот эффект, губительный для развивающегося плода, оказался полезным для онкологических больных: применение талидомида эффективно при лечении некоторых видов рака на ранних стадиях. Талидомид уже прошёл клинические испытания в качестве противоопухолевого препарата, а также для лечения больных проказой или СПИДом. Разумеется, его не следует назначать будущим мамам.
Вант-Гофф стал первым в истории лауреатом Нобелевской премии по химии. Случилось это в 1901 году. Однако премия учёному была присуждена не за открытие пространственного строения молекул и идею асимметрического атома углерода, а за совсем другие достижения — «открытие законов химической динамики и осмотического давления растворов». Лишь в 1975 году, сто лет спустя после открытия Вант-Гоффа, исследования в области стереохимии органических молекул и реакций были удостоены этой престижной награды. Её получили швейцарский химик Владимир Прелог и его австралийский коллега Джон Корнфорт. Выступая на церемонии вручения премии, Владимир Прелог отметил, что «большинство соединений, участвующих в основных жизненных процессах, такие как аминокислоты или углеводы, оптически активны, причём для каждого из них в природе существует только один из двух возможных энантиомеров... Это — одна из главных загадок, связанных с происхождением жизни». И продолжил: «Природа — это великий Мастер стереоспецифичности, который специально для поддержания высокой энантиомерной чистоты создал особые катализаторы — ферменты. Тайны их активности и специфичности невозможно раскрыть без знания стереохимии».
За прошедшие с тех пор десятилетия химики достигли огромных успехов в понимании механизмов действия биологически активных веществ — ферментов, гормонов, лекарственных препаратов. И чем глубже мы познаём химию живого, тем яснее становится ключевая роль стереохимии в молекулярных основах жизни. И тем выше мы ценим воображение и смелость голландского учёного Вант-Гоффа, который ввёл в химию новое пространственное измерение и сделал её трёхмерной!
***Предположим, вам завязали глаза и попросили разделить кипу из 100 перчаток на две стопки, одна из которых должна состоять только из перчаток на правую, а другая только на левую руку. Как вы можете сделать это, если перчатки не различаются ни по весу, ни по запаху, ни по каким-либо другим свойствам? То есть они абсолютно одинаковые за исключением того, что половина из них на правую, а половина на левую руку (выражаясь химическим языком, смесь перчаток — это «рацемат»). Очевидно, один из способов решить проблему — перемерить все перчатки. В этом случае ваша рука будет выступать в роли энантиомерно чистого реагента. Надетая на правую руку «праворукая» перчатка будет сидеть как влитая, тогда как «леворукая» создаст ощущение дискомфорта.
***Структурные формулы аспартама, никотина и талидомида. Незначительные, на первый взгляд, изменения в пространственном расположении атомов у асимметрического атома углерода (отмечен звёздочкой) нередко приводят к драматическим изменениям свойств.
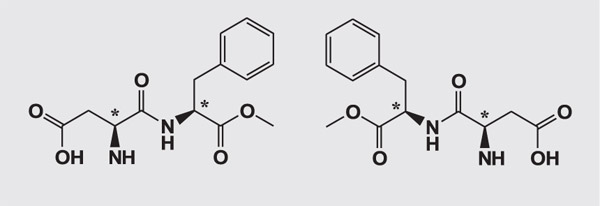
Аспартам. Слева — стереоизомер, имеющий сладкий вкус (в 200 раз слаще сахара), справа — горький энантиомер.
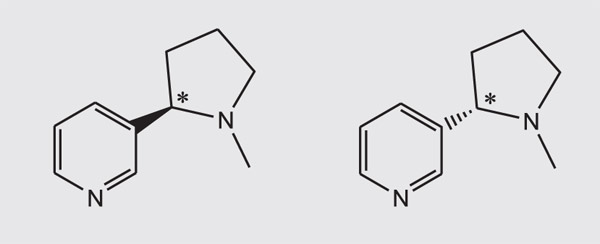
Никотин. Слева — менее токсичный синтезированный энантиомер, справа — более токсичный природный.
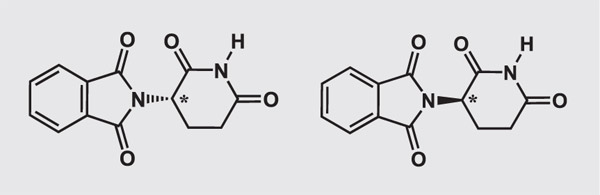
Талидомид. Один из энантиомеров обладает тератогенным действием.
Стереохимические (пространственные) формулы показывают относительное расположение атомов в пространстве. В них обычные чёрточки изображают химические связи в плоскости рисунка, утолщённые с одного конца чёрточки — связи, направленные в сторону читателя, пунктирные связи — от него.
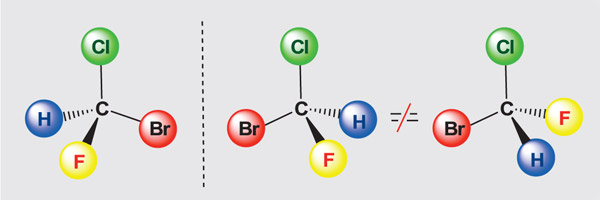
Бромфторхлорметан CHBrClF (слева) и его энантиомер (в центре) — зеркальные отражения друг друга. Зеркало представлено вертикальным пунктиром. Правая структура, после знака «не равно», получена вращением левой структуры вокруг вертикальной оси C–Cl. Хорошо видно, что центральная и правая структуры не совпадают.
Если в молекуле есть n асимметрических атомов углерода, то число стереоизомеров равно 2n — это утверждение называют правилом Ле Беля — Вант-Гоффа. Например, глюкоза имеет 16 стереоизомеров, а витамин B12 — 29 = 512 стереоизомеров. Полный стереохимический синтез витамина В12 был осуществлён в 1972 году под руководством Роберта Вудворда (США) и Альберта Эшенмозера (Швейцария). Работа длилась более десяти лет, а схема синтеза включала 95 стадий! Чем сложнее молекула, тем больше существует вариантов расположения её атомов в пространстве.
Асимметрическим называют любой атом углерода, который связан с четырьмя разными заместителями — атомами или группами атомов. Молекулы, содержащие такой атом, могут иметь две пространственные формы, которые не совпадают друг с другом, а являются зеркальными отражениями, то есть энантиомерами. Левая и правая рука могут служить простым примером энантиомеров.
Комментарии к статье
1 J. Wislicenus, Ann. Chem. Pharm., 1873, 166, 47.
2 Van't Hoff, J. H., «Voorstel tot uitbreiding der tеgenwoordig in de scheikunde gebruikte structuurformules in de ruimte, etc.», Utrecht, 1874; цитируется по англ. переводу: «Classics in the Theory of Chemical Combination», edited by O. T. Benfey, Dover Publications Inc., New York, 1963, p. 152.
3 Le Bel, J. A., Bull. Soc. Chim., [2], 22, 337—347 (1874).
4 Цитируется по статье: F. G. Riddel, M. J. T. Robinson. Tetrahedron., 1974, 30, 2001—2007.
5 H. Kolbe. J. Prakt. Chem., 15, 473—477 (1877).
6 Hoff, J. H. van't, public address in Utrecht, 16 May 1904, опубликована в книге: E. J. Cohen, Jacobus Henricus van't Hoff. Sein Leben und Wirken, Academische Verlagsgesellschaft, Leipzig, 1912, p. 5, цитируется по англ. переводу: O. T. Benfey's introduction to his translation of van't Hoff's inaugural address, (1878), «The Role of Imagination in Science», J. Chem. Educ., 37, 467 (1960).




